 124460, Москва, Зеленоград, НИИФП, ООО "КОМРИС"
124460, Москва, Зеленоград, НИИФП, ООО "КОМРИС"
т./ф. 8 499 710 57 27,
E-mail : smkuzmin@mtu-net.ru
www.1filtr.ru , http://www.mtu-net.ru/comrisfilter
Некоторые методические вопросы применения порошкового фильтра для выделения
цист лямблий и ооцист криптоспоридий из воды.
18 июня
Кузьмин С.М., Романенко Н.А.
SUMMARY.
Powder
Filter Medium Using for Liamblia intestinalis (Giardia) cysts and Cryptosporidium (Tyzzer
cryptosporidium) oocysts Extraction from Water.
June 18, 2003
The extraction of Giardia cysts
and Cryptosporidium oocysts from large samples of water with the precoat bed of filter medium
method is discussed. The schematic representation and operation
principle of the apparatus are
given. Procedures of cysts/oocysts
elution from filtering medium with flotation or settling is described in detail. High recovery rate
(70-90%%) is accounted for cysts/oocysts
in the technology are not undergone to mechanical injury nor in filtration
(because low pressure gradient), nor in separation from filtering medium (because
mechanical disturbance absence), but are completely separated from the last in
elution process because total filter
structure disintegration and cysts/oocysts releasing from the temporary pores.
РЕЗЮМЕ.
Рассматривается метод
выделения цист лямблий и ооцист криптоспоридий из больших объемов воды с
использованием техники намывного порошкового фильтра. Дается схема аппарата,
принцип его работы, подробно описана методика отделения цист и ооцист от
фильтрующего материала отстаиванием и флотацией. Высокая эффективность
выделения (коэффициент отдачи фильтра) объясняется тем, что цисты/ооцисты в
рассматриваемой технологии не подвергаются механическим травмам ни в процессе
фильтрации (из-за малого градиента давления), ни при отделении их от фильтрующего материала (из-за
отсутствия механических воздействий), а полностью отделяются от него в процессе
элюции благодаря полному распаду структуры фильтра с освобождением цист/ооцист
из временных пор. (Библ. 11)
Организация и проведение производственного
мониторинга за качеством питьевой воды по паразитологическим показателям
[1,2,3] требуют постоянного совершенствования методической базы по индикации цист
лямблий и ооцист криптоспоридий [4] . Первой обязательной стадией такого
определения является выделение паразитарных объектов из больших объемов
исследуемой воды (10,50, 100, 380,
В России для больших проб
воды недавно начал выпускаться
пробоотборник-концентратор [9] с более простой
процедурой пробоотбора и отделения ЦО от
фильтра.
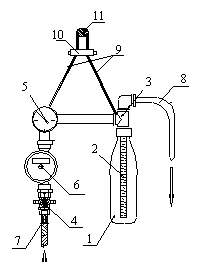 Этот
аппарат[1] (рис.1) содержит фильтр, состоящий из
пластиковой бутылки(1) и размещаемого в ней фильтровального элемента
Крапухина(2), который присоединен к распределительной головке(3); кран(4); манометр(5);
счетчик(6); входной(7) и выходной(8) патрубки. В рабочем положении аппарат вешается на подвеске(9) с регулятором(10) на
опору (11).
Этот
аппарат[1] (рис.1) содержит фильтр, состоящий из
пластиковой бутылки(1) и размещаемого в ней фильтровального элемента
Крапухина(2), который присоединен к распределительной головке(3); кран(4); манометр(5);
счетчик(6); входной(7) и выходной(8) патрубки. В рабочем положении аппарат вешается на подвеске(9) с регулятором(10) на
опору (11).
Порошковый
фильтрующий материал засыпают в бутылку для концентрата(1), которую затем присоединяют
к распределительной головке(3). Открывают кран(4), и исследуемая вода через
счетчик(6) и распределительную головку(3) поступает в бутылку(1), взмучивает
порошковый фильтрующий материал и, проходя через элемент Крапухина(2), формирует на его поверхности
намывной фильтр. Профильтрованная вода через распределительную головку(3) и
выходной патрубок(8) покидает устройство.
Гидробиологические объекты и паразитарные патогены задерживаются на
фильтре. После того, как через установку пройдет заданное количество воды,
кран(4) закрывают, фильтр с задержанными частицами смывается с поверхности
элемента Крапухина(2) в бутылку(1). Ее отсоединяют от головки(3), закрывают,
маркируют и транспортируют в лабораторию. Отделение биочастиц от фильтрующего
материала производят отстаиванием или флотированием (см. далее).
Мы не обнаружили более ранних сведений о
применении порошкового намывного фильтра для выделения ЦО. После размещения в
Интернете [9] информации о пробоотборнике-концентраторе нами получен ряд специальных вопросов от иностранных специалистов
(Гон-Конг, Сингапур, Кельн и Токио). Содержание этих вопросов, по-видимому,
хорошо показывает, что интересного есть в порошковой технологии по сравнению с
существующими. Поэтому, мы нашли естественным изложить подробности
порошковой технологии в виде интервью так как оно сложилось (оригинал см. клик FAQ [9]). Эти вопросы
и ответы могут быть интересны и для Российских
специалистов, не только потому, что
затрагивают некоторые общие методические вопросы анализа воды по
паразитологическим показателям, но и
раскрывают некоторые подробности, интересные для тех, кто уже пользуется
аппаратами этого типа . Он сертифицирован Федеральным центром госсанэпиднадзора
Минздрава Российской Федерации и уже
применяется многими центрами госсанэпиднадзора
(в г. Курск и Курской обл., в нескольких городах Ханты-Мансийского автономного
округа, в г. Солнечногорск и Долгопрудный Московской обл. и др.).
1. Сообщите подробности выполнения
отделения микроорганизмов от материала фильтра флотацией. Каковы применяемые
объемы?
|
Операция |
Полученный материал для дальнейше обработки |
Общий
объем, примерно, мл |
|
Снятие с поддерживающей сетки намывного слоя |
порошковый фильтр + плотные частицы+ целевые частицы+ вода |
100[2] |
|
центрифугирование |
осадок (порошковый фильтр+плотные частицы+целевые частицы) |
20-25 |
|
суспендирование
во флотирующем растворе |
суспензия (порошковый фильтр+плотные частицы + целевые
частицы) |
100-150[3] |
|
центрифугирование
и сбор флотанта |
флотант с
целевыми частицами |
10-15 |
|
разбавление
флотанта водой[4] |
суспензия
целевых частиц |
100-150 |
|
центрифугирование |
осадок целевых
частиц |
0.5 и менее |
2.
Контактирует
ли оператор в процессе концентрирования
и разделения с микроорганизмами?
Во время концентрирования система закрыта и оператор не контактирует с микроорганизмами. Но когда бутылка отсоединяется от аппарата и вплоть до фиксирования микроорганизмов возможность такого контакта имеется. Поэтому эти операции рекомендуется выполнять в латексных перчатках. В случае необходимости аппарат рекомендуется дезинфицировать 1:10000 раствором марганцовки или 5% раствором хлорамина.
3.
Эффективность
выделения (или коэффициент отдачи фильтра) Cryptosporidium oocysts and Giardia
cysts?
По крайней мере три фактора
определяют выход ЦО при выделении: полнота задержки фильтром, полнота отделения от фильтрующего материала и
стабильность ЦО в этих в этих процессах.
Полнота задержки фильтром и полнота отделения от него определяются спецификой
применяемого фильтрующего материала. Кстати, насколько нам известно, только рассматриваемый порошковый фильтр был
разработан специально для выделения ЦО. Другие исследователи пытаются
приспособить для этой цели уже существующие фильтры. Стабильность ЦО зависит от
множества факторов: состояния донора и его иммунного статуса, стадии заболевания,
применяемых медикаментов, деталей методики выделения и очистки препарата, и
т.д.
Коэффициент отдачи рассматриваемого порошкового фильтра, определяемый
фильтрованием
4. Процесс элюции в отделении цист/ооцист от фильтрующего материала?
Элюция может быть выполнена двумя способами: отстаиванием и флотацией.
Отстаивание деликатнее по отношению к микроорганизмам поскольку позволяет избежать осмотического шока при флотации, и поэтому предпочтительнее в тонких работах, например, определении жизнеспособности. Пластиковая бутылка, содержащая снятый с поддерживающей сетки фильтрующий материал кладется на бок на 30 минут, для оседания фильтрующего материала, затем вода осторожно декантируется в сосуд для сбора микроорганизмов. Примерно 100 мл воды или другого элюирующего раствора наливают в бутылку, тщательно встряхивают и опять отстаивают 30 минут, надосадочную жидкость декантируют в сосуд для сбора микроорганизмов. Операцию повторяют еще раз. Элюат (примерно 300 мл) далее обрабатывают в соответствии с задачей.
Флотация более интенсивный процесс, но более жесткий по отношению к микроорганизмам из-за возможности осмотического шока в концентрированном флотирующем растворе . Поэтому, при выделении ЦО только для подсчета, целесообразно зафиксировать их формалином перед добавлением флотирующего раствора.
5. Имеются сообщения о больших потерях цист/ооцист в процессе флотации;
можете Вы прокомментировать это в связи с Вашей технологией?
Возможно, что дело не только во флотации, но и в других условиях
определения. Можно предположить, что капсула ЦО получает микроповреждения в
жесткой операции отделения ЦО от фильтрующего материала путем его стирки в
пластиковых мешках, сонификации [6] или
даже взбалтывания [8]. Затем ЦО могут терять через эти микроповреждения
внутриклеточную воду при помещении их в сильно осмомолярный флотирующий
раствор, их плотность возрастает, объем уменьшается, плавучесть уменьшается
настолько, что частицы не всплывают, а садятся на дно пробирки.
Возможность такого процесса принималась во внимание при разработке
порошкового фильтра. Он не травмирует
ЦО. Они задерживаются во временных порах, образованных частицами
порошка, когда слой порошкового фильтра наносится на опорную сетку, и
освобождаются, когда намывной слой смывается с опорной сетки.
6. Высокое давление не рекомендуется для фильтрации, а у Вас оно доходит
до 3.5 ат.?
Очевидно давление фильтрации
может заталкивать ЦО в поры фильтрующего
материала необратимо, или даже продавливать их через фильтр, или разрушать,
когда градиент давления на ЦО велик, как например, на ядерных трековых
мембранах, где он равен практически всему приложенному давлению. Эти явления
могут снижать выход ЦО. В нашем случае толщина фильтрующего слоя около 3мм или 3000 мкм. Тогда градиент давления составляет 3ат./3000мкм=0.001 ат/мкм. Приняв размер цисты равным 10 мкм/циста получим перепад давления 0.001 ат/мкм х 10мкм=0.01 ат/ циста .
Конечно, градиент давления несколько возрастает по мере забивки фильтра, но
затыкание в поры ЦО в любом случае остается обратимым, потому что поры
временные.
Таким образом, наши коллеги из Японии, Сингапура, Гон-Конга и
Германии своими вопросами выделили те
методические сложности , которые, по-видимому, успешно преодолеваются применением порошкового намывного фильтра. Это
- простота и легкость отделения ЦО от фильтрующего материала и высокая эффективность выделения.
Литература
1.
СанПиН 2.1.4.1074-01
"Питьевая вода. Гигиенические требования к качеству воды
централизованных систем питьевого водоснабжения. Контроль
качества"
2.
СанПин 2.1.4.1116-02
"Питьевая вода. Гигиенические требования к качеству воды,
расфасованной в емкости. Контроль качества".
3.
СанПин 2.1.2.1188-03 "Плавательные бассейны. Гигиенические
требования к устройству, эксплуатации и качеству воды. Контроль
качества".
4. МУК 4.2.964-00
"Санитарно-паразитологическое исследование воды хозяйственного и питьевого
использования".
5.
K.M. Shepherd and A.P.
Wyn-Jones, "Evaluation of different
filtration techniques for the concentration of cryptosporidium oocysts from
water", Water Science and Technology, Vol.31, No5-6, pp.425-429, 1995.
6. Proposed Test Method for Giardia Cysts and
Cryptosporidium Oocysts in Low-Turbidity
Water., "1992 Annual Book of ASTM Standards, sec.11, Water and
Environmental Technology, vol.11.02"
7.Drinking Water Inspectorate
standard operating protocol for the monitoring of Cryptosporidium
oocysts in treated water supplies to satisfy
the
water supply (water quality) regulations 2000, SI No.3184 ENGLAND
the water supply (water quality) regulations
2000, SI No.3911(W.323) WALS
part1 - Sampling and Trasportation of Samples
11 February 2003
Интернет
адрес: http://www.dwi.gov.uk/regs/crypto/pdf/sop%20part%201.pdf
8.То же
part2 - Laboratory and Analytical Procedures
24 January 2003
Интернет
адрес: http://www.dwi.gov.uk/regs/crypto/pdf/sop%20part%202.pdf
9. Сайт ооо "КОМРИС"
Интернет адрес: http://www.mtu-net.ru/comrisfilter
10. Методические рекомендации "Использование аналитических
трековых мембран для пробоподготовки воды и исследования на показатели
паразитарной безопасности",
Министерство здравоохранения Российской Федерации, Федеральный центр
госсанэпиднадзора, Лабораторный Совет госсанэпиднадзора,
11.
"Использование модельных тестов цист лямблий и ооцист криптоспоридий для
гигиенической оценки эффективности водоочистки", Методические указания
МУК4.2.1174-02, Минздрав России, 2003.
 124460, Москва, Зеленоград, НИИФП, ООО "КОМРИС"
124460, Москва, Зеленоград, НИИФП, ООО "КОМРИС"
т./ф. (499) 710 57 27,
E-mail : smkuzmin@mtu-net.ru
www.1filtr.ru , http://www.mtu-net.ru/comrisfilter
Рукопись статьи в юбилейный (70 лет) сборник КГУ.
Применение порошкового фильтра для определения в воде возбудителей
паразитарных болезней.
Романенко Н.А. , Кузьмин С.М.
ИМПиТМ им. Марциновского ММА им. И.М.Сеченова,
ФГУП НИИ физических проблем
им. Ф.В.Лукина.
Накануне 70-летия в Курском государственном университете появилась Научно - исследовательская лаборатория "Паразитология" . Мы считаем это адекватным ответом Русской системы образования на вызов времени, состоящий в глобальном ухудшении среды обитания человека и параллельное ему ухудшение здоровья, иммунитета и др. Среди неблагоприятных факторов окружающей среды уже второе десятилетие привлекает внимание паразитарное загрязнение питьевой воды цистами лямблий и ооцистами криптоспоридий. Эти объекты появились в поле зрения инфекционистов и экологов в результате определения возбудителей нескольких случаев массового заражения населения кишечными инфекциями через питьевую воду в США.
У проблемы паразитарного загрязнения воды много аспектов : клинический, технологический (водоподготовка), экологический, экономический, политический и аналитический . Последний является основанием всего этого сооружения, т.к. без определения объекта остальные аспекты делаются беспредметными. Пользуясь предоставленной возможностью и предлогом, в данной статье мы рассматриваем только отдельные вопросы паразитарной аналитики воды, которые в настоящий момент нас просто больше интересуют, и в решении которых мы достигли определенных успехов, которыми готовы поделиться и которые надеемся развивать в содружестве с НИЛ "Паразитология".
Все
методики обнаружения цист/ ооцист (далее
ЦО) в воде включают концентрирование их
из больших объемов проб воды (от
Концентрирование
цист/ооцист из больших объемов воды.
Вероятность обнаружения ЦО тем больше, чем больше исследуемый объем (1).
Поэтому, исследователи стремяться все время увеличивать этот объем. В настоящее
время наибольший объем пробы в санитарном контроле достигнут в Великобритании -
1000л. Задачка состоит в том, чтобы из такого объма ЦО загнать на предметное стекло микроскопа.
Первый этап
по концентрированию ЦО из больших объемов
в настоящее
время выполняется фильтрованием исследуемой воды через патронные волоконные и
патронные мембранные фильтры, обладающие достаточным ресурсом для этого.
Несколько
лет назад нами для этой цели предложены порошковые фильтры [2], которые
применяются пока только в России, в том числе в Курске и Курской области .
В настоящее
время выпускается порошковый пробоотборник-концентратор [2,3] , разработанный специально для
выделения ЦО из воды, в то время как
другие исследователи пытаются приспособить для этой цели уже существующие
патронные фильтры общего назначения.
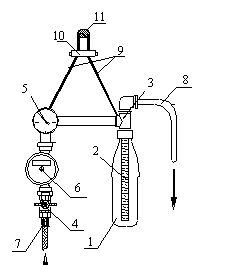
Этот аппарат[5] (рис.1) содержит фильтр, состоящий из
пластиковой бутылки(1) и размещаемого в ней фильтровального элемента Крапухина(2),
который присоединен к распределительной головке(3); кран(4); манометр(5); счетчик(6);
входной(7) и выходной(8) патрубки. В рабочем положении аппарат вешается на подвеске(9) с регулятором(10) на
опору (11).
Порошковый фильтрующий
материал засыпают в бутылку для концентрата(1), которую затем присоединяют к
распределительной головке(3). Открывают кран(4), и исследуемая вода через
счетчик(6) и распределительную головку(3) поступает в бутылку(1), взмучивает
порошковый фильтрующий материал и, проходя через элемент Крапухина(2), формирует на его
поверхности намывной фильтр. Профильтрованная вода через распределительную
головку(3) и выходной патрубок(8) покидает устройство. Гидробиологические объекты и паразитарные патогены задерживаются
на фильтре. После того, как через установку пройдет заданное количество воды, кран(4)
закрывают, фильтр с задержанными частицами смывается с поверхности элемента
Крапухина(2) в бутылку(1). Ее отсоединяют от головки(3), закрывают, маркируют и
транспортируют в лабораторию.
Отделение
паразитарных объектов от фильтрующего материала.
После
пропускания пробы воды через применяемые фильтры выполняется операция по
отделению задержанных паразитарных объектов от фильтрующего материала.
Волоконные
патронные фильтры к настоящему времени морально устарели из-за того, что это
отделение выполнялось долго, сложно и
трудно. До недавнего времени для выделения цист лямблий и ооцист криптоспоридий
(далее ЦО) патронный фильтр разрезали на части, которые отмывали в пластиковых
мешочках, иногда применяя ультразвуковую вибрацию (сонификацию). Из нескольких
литров полученного элюата далее готовили препарат для микроскопирования [ 4 ] .
Рис.1
Недавно Великобритания, занимая место лидера в разработке и внедрении в
санитарную практику паразитологического анализа воды, ввела объем пробы 1000л,
отбираемой в течение суток. Методика была усовершенствована и обеспечена
соответствующим инструментарием. Отбор пробы [5] осуществляется в
автоматическом режиме пробоотборными машинами (sampling machine).
Фильтрация производится через патронные фильтры утвержденных марок, которые
после окончания фильтрации доставляются в аккредитованную лабораторию. Их не
разрезают, а прямо в корпусе подсоединяют к отмывочной машине (wash station) [6], заполняют элюирующим раствором и производят
смыв осадка с материала фильтра . Отмывочные машины применяют двух типов:
плунжерную и вибрационную. Плунжерная
движением плунжера создает переменное положительное и отрицательное давление на
фильтрующей поверхности и соответствующие потоки жидкости, которые приводят к
отделению осадка от поверхности материала. Тот же результат в вибрационной
машине достигается за счет интенсивного взбалтывания в корпусе отмывочной
жидкости. Операцию повторяют несколько
раз и получают несколько литров элюата для дальнейшей обработки. Из этого
элюата на центрифуге осаждают концентрат различных частиц, содержащий паразитарные
объекты.
При
использовании же порошкового фильтра не
требуется отделения от фильтрующего материала в качестве отдельной операции.
Аппарат дает всего примерно 100мл концентрата, содержащего наряду с искомыми
паразитарными объектами другие частицы,
содержавшиеся в воде, и частицы порошкового фильтра.
Отделение же паразитарных объектов от фильтрующего материала производится в
процессе очистки концентрата, выполняемой для выделения паразитарных объектов
из массы других частиц, мешающих при микроскопическом исследовании.
Очистка концентрата паразитарных объектов.
Традиционным способом выполнения этой задачи, в том числе и нами,
является флотация. Несмотря на то, что флотация применяется практически в
каждой паразитологической методике, теоретические основы этого процесса практически
не рассматриваюся в методических пособиях по паразитологии. Возможно поэтому у
некоторых паразитологов существуют несколько искаженные представления об этом
процессе и практические ошибки. Теоретические основы флотации подробно
рассмотрены нами в [3]. Здесь же обращаем внимание читателя на главное
обстоятельство, от которого зависит результат флотации (всплывание во флотирующем
плотном растворе) паразитарных объектов - это целостность, непроницаемость
капсулы объекта как для внутреннего содержимого, так и для компонентов
флотирующего раствора, обеспечивающая сохранение первоначальной плотности
паразитарных объектов при помещении их во флотирующий раствор.
Новейшим методом очистки паразитарных
объектов от сопутствующих частиц является
иммуно-магнитная сепарация, активно внедряемая в
паразитологический анализ в США и Великобритании [6]. По этому методу к концентрату объемом в
несколько миллилитров, полученному центрифугированием элюата с патронных
фильтров, добавляются бусинки диаметром около 2мкм из парамагнитного материала,
на поверхности которых иммобилизованы антитела к искомым паразитарным объектам.
Бусинки слипаются с искомыми паразитарными объектами селективно благодаря специфическому взаимодействию
антиген-антитело. Пробирка помещается в постоянное магнитное поле, бусинки
прилипают к стенка, а все остальное содержимое отсасывается. Бусинки помещаются
в перемешивающее устройство где паразитарные объекты смываются с поверхности бусинок
и из них готовится препарат для микроскопического исследования. Сообщается об очень высоких выходах на модельных пробах - 95% [7]
При
сравнении и выборе этих методов (флотации и иммуномагнитной сепарации) следует
иметь в виду имеющиеся сообщения о низкой эффективности открытия с применением флотации по сравнению с иммуномагнитной
сепарацией . Однако при этом следует иметь в виду, что как мы уже отмечали
выше, результат флотации решающим образом зависит от состояния паразитарных
объектов, целостности их оболочки. В то же время, иммуномагнитная сепарация от
этого фактора по смыслу не должна зависеть, поскольку антигенные детерминанты
сохраняются и на поврежденных, нежизнеспособных объектах. Это обстоятельство,
мы полагаем, следует учитывать при сравнении результатов.
О
функциональных особенностях порошкового фильтра.
У фильтров для выделения
паразитарных объектов из воды две основных потребительских характеристики: ресурс
по объему пробы и коэффициент отдачи объектов. Ресурс по воде - это
максимальный объем пробы, который можно профильтровать через данный фильтр.
Этот ресурс оценивается по питьевой воде, как более стандартному объекту. Чем
больше ресурс, тем полезнее фильтр для обнаружения паразитарных объектов, т.к.
вероятность обнаружения тем больше, чем больше объем исследованной воды [3]. По
этому показателю (до 1000л) порошковый фильтр соизмерим с патроными фильтрами.
Эффективность открытия ЦО определяется суммой их потерь в процессе
определения. Они теряются на стадии фильтрации, на стадии отделения от
фильтрующего материала, на стадии очистки, приготовления препарата для микроскопического
исследования и на стадии самого исследования-подсчета. Полную картину всех
потерь пока составить трудно ввиду многообразия методик и некоторых деликатных
подробностей их выполнения, например, качества модельных суспензий.
Однако, имеются работы, прямо указывающие на то, что основные потери объектов происходят где-то в процессе фильтрования и отделения от фильтра. Работая по знаменитому методу 1622, включающему самые современные операции: фильтрование, иммуномагнитную сепарацию, иммунофлуоресцентную микроскопию, авторы [7] установили, что эффективность выявления ооцист в модельной смеси иммунофлуоресцентным методом достигает 95%, но, если провести фильтрование, то выявляется только около 14%. Обращает на себя внимание одинаково малый коэффициент отдачи патронных фильтров у разных авторов [7,8], работающих разными методиками и в разное время.
Коэффициент же отдачи рассматриваемого порошкового фильтра, определяемый
фильтрованием
У такой сравнительно высокой отдачи можно найти весьма простые объяснения, если рассмотреть возможные потери в процессе фильтрования и отделения от фильтрующего материала с точки зрения особенностей строения и функционирования порошкового фильтра. Эти потери определяются по крайней мере тремя факторами: полнотой задержки объектов фильтром, полнотой отделения от него и стабильностью объектов в этих процессах.
Наблюдается экспериментально, что давление фильтрации может заталкивать ЦО в поры фильтрующего материала
необратимо, или даже продавливать их через фильтр, или разрушать, когда
градиент давления на ЦО велик, как например, на ядерных трековых мембранах, где
он равен практически всему приложенному давлению. Эти явления могут снижать
отдачу ЦО фильтром. В случае порошкового
фильтра толщина фильтрующего слоя около 3мм
или 3000 мкм. Тогда градиент давления
составляет 3ат./3000мкм=0.001 ат/мкм. Приняв размер цисты равным 10 мкм/циста получим перепад давления 0.001 ат/мкм х 10мкм=0.01 ат/ циста. Можно
сказать, что порошковый фильтр - низкоградиентный.
Естественно предположить, что капсула ЦО может получить микроповреждения
в жесткой операции отделения ЦО от фильтрующего материала путем его стирки в
пластиковых мешках, сонификации [4] или
даже взбалтывания [6]. Затем ЦО могут терять через эти микроповреждения
внутриклеточную воду при помещении их в сильно осмомолярный флотирующий
раствор, их плотность возрастает, объем уменьшается, плавучесть уменьшается
настолько, что частицы не всплывают, а садятся на дно пробирки. Если же капсула
повреждена настолько. что проницаема для солей или сахарозы, то происходит выравнивание
плотности раствора и содержимого частицы, при котором флотация невозможна.
Возможности
таких процессов принималась во внимание при разработке порошкового фильтра. Он
не травмирует ЦО. Они задерживаются во
временных порах, образованных частицами порошка, когда слой порошкового фильтра
наносится на опорную сетку, и освобождаются, когда намывной слой смывается с
опорной сетки. Дальнейшее отделение
объектов от фильтрующего материала не требует таких механических воздействий
как сонификация, стирание в пластиковых мешочках, интенсивное взбалтывание и
т.п.
Стабильность
паразитарных объектов в этих операциях зависит от качества первоначальной
суспензии объектов, которые могут быть изначально повреждены вследствие
иммунной атаки, воздействия лекарств, особенностей методики выделения и
очистки и других жизненных факторов.
Поэтому, сравнение различных методик, оценку каждой стадии определения
корректно проводить на суспензии одного качества. Это очевидное требование
делает пока неоднозначным сравнение
результатов разных авторов.
Итак, после очистки тем или другим способом
мы имеем или осадок или флотант,
содержащий паразитарные объекты.
Приготовление
препарата для микроскопирования.
В настоящее время принято приготовлять препарат объектов для идентификации
и подсчета ЦО под микроскопом на мембранном фильтре [4]. Недавно в России предложено применять
для этого прозрачные трековые мембраны [11].
Мы
предложили для выполнения этой операции специальное устройство [12],
принципиальная схема которого показана на рис. 2.
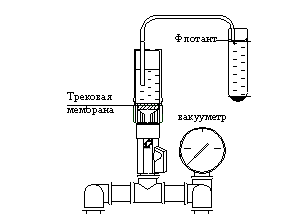
Рис.2 Отборник
флотанта фильтрующий, схема, вид спереди.
Устройство
предназначено для нанесения паразитарных объектов путем вакуумного фильтрования
флотанта непосредственно из центрифужной пробирки на прозрачную трековую мембрану диаметром
25мм для последующего микроскопического исследования.
Промывку от
флотанта, окрашивание, фиксирование и т.п. производят, подавая на мембрану
соответствующие растворы.
Микроскопирование
объектов на прозрачной трековой мембране.
Приготовленный
таким образом препарат на прозрачной трековой мембране помещают на предметное
стекло и исследуют под микроскопом.
Для
предварительной оценки трудоемкости микроскопирования прозрачной трековой
мембраны можно применить следующий подход.
Нам
следует просмотреть площадь фильтра
S=pD2/4
,
где
- D (мм)- диаметр мембраны,
просканировав
его по дорожке площадью
S=dL,
где d (мм) - диаметр поля зрения объектива микроскопа, L (мм) -
длина дорожки сканирования .
dL=pD2/4 , откуда L=pD2/4d.
Например,
для объектива х90 d=0.2 , тогда длина сканирования мембраны с D=25 составит
L= (3.14
х 625) /(4х0.2) =
это
эквивалентно просмотру числа полей
зрения
n=L/d = 2454/0.2=12271.
Опытный
микроскопист может сканировать около 2-х полей/сек (120/мин), тогда времени t на сканирование поверхности фильтра потребуется
12271/2=6135сек, или t= 6135/60 =102 минуты. Это минимальное время на
сканирование. Его надо умножить на весьма неопределенный коэффициент затрат на
рассматривание объектов и идентификацию, который очень сильно зависит от
количества объектов в поле зрения. Аналогично можно оценить минимальное время
сканирования для других диаметров мембран и объективов.
Таб. 1 Расчет примерного времени сканирования
трековой мембраны диаметром
|
объектив |
диаметр
поля зрения d,
мм |
длина
дорожки сканирования L, мм |
число
полей зрения n=L/d |
примерное
время сканирования, мин., t=n/120 |
|
х10 |
2 |
245 |
123 |
1 |
|
х20 |
1 |
490 |
490 |
4 |
|
х40 |
0.5 |
980 |
1960 |
16 |
|
х90 |
0.2 |
2454 |
12271 |
102 |
Недавно возникла очень интересная мысль [11]
проводить микроскопическое исследование прямо на большом (диаметр
Таб.2 Расчет примерного
времени сканирования трековой мембраны диаметром
|
объектив |
диаметр
поля зрения d, мм |
длина
дорожки сканирования L, мм |
число
полей зрения n=L/d |
примерное
время сканирования, мин., t=n/120 |
|
х10 |
2 |
7918 |
3959 |
33 |
|
х20 |
1 |
15837 |
15837 |
132 |
|
х40 |
0.5 |
31674 |
63348 |
528 |
|
х90 |
0.2 |
79185 |
395925 |
3299 |
Таким
образом этот "прямой" метод может оказаться привлекательным, если
имеется достаточный для его выполнения трудовой ресурс
Мы здесь рассказали только о некоторых методических проблемах определения паразитарного загрязнения воды. Наш выбор, и наши оценки методов определяются не только научными доводами, но и найденными нами решениями и возможностями, имеющимися в нашей стране в данный период. Текущее состояние порошковой методики резюмировано в таблице 3.
Таб.3 Схема
определения паразитарных объектов в воде с применением порошкового фильтра.
|
Операция |
Полученный материал для дальнейшейобработки |
Общий объем, примерно, мл |
|
Фильтрование, снятие с
поддерживающей сетки намывного слоя |
суспензия (порошковый фильтр +
плотные частицы+ целевые частицы) в воде |
100 |
|
центрифугирование |
осадок (порошковый фильтр+плотные
частицы+целевые частицы) |
20-25 |
|
суспендирование во флотирующем растворе |
суспензия (порошковый фильтр +плотные частицы + целевые
частицы) во флотирующем растворе |
100-150 |
|
центрифугирование |
флотант с целевыми частицами |
10-15 |
|
сбор и фильтрование флотанта через
прозрачную трековую мембрану , обработка (окрашивание, фиксация и др.) ЦО на
трековой мембране |
Препарат целевых частиц для
микроскопического исследования |
- |
Паразитологическая аналитика воды пока не "устоялась", многие вопросы остаются спорными, развиваются различные методики определения, по которым у разных авторов получаются разные результаты (напр. [13]), и это нормально для развивающегося направления. Для дальнейшего развития методических основ паразитоаналитики требуются свежие силы, квалифицированные специалисты, и мы надеемся и желаем, чтобы НИЛ "Паразитология" воспитала такие кадры в ближайшие годы.
Литература.
1. Кузьмин Е.С., Кузьмин С.М.,
Белова Е.Г., Романенко Н.А., "Опыт использования распределения малых чисел
Пуассона для оценки объемов проб воды при санитарно-паразитологическом
исследовании", Информационный бюллетень "Здоровье населения и среда
обитания", М. 2003, №10, стр.41-45.
2. Патент России №2169917.
3.Сайт
ооо "КОМРИС",
Интернет
адрес: http://www.mtu-net.ru/comrisfilter
4.
"Proposed Test Method for Giardia Cysts and Cryptosporidium
Oocysts in Low-Turbidity Water.,
"1992 Annual Book of ASTM Standards, sec.11, Water and Environmental
Technology, vol.11.02"
5
Drinking Water Inspectorate
standard operating protocol for the monitoring of Cryptosporidium
oocysts in treated water supplies to satisfy
the
water supply (water quality) regulations 2000, SI No.3184 ENGLAND
the water supply (water quality) regulations
2000, SI No.3911(W.323) WALS
part1 - Sampling and Trasportation of Samples
11 February 2003
Интернет
адрес: http://www.dwi.gov.uk/regs/crypto/pdf/sop%20part%201.pdf
6. То же
part2 - Laboratory and Analytical Procedures
24 January 2003
Интернет
адрес: http://www.dwi.gov.uk/regs/crypto/pdf/sop%20part%202.pdf
7.Yao Yu Feng, Say Leong Ong, Jiang Yong Hu,
Lian Fa Song, Xiao Lan Tan and Wun Jern Ng, Effect of Particles on the Recovery
of Cryptosporidium Oocysts from Source Water Samples of Various
Turbidities, Applied and Environmental Microbiology,
April 2003, p.1898-1903, Vol.69.
8.K.M. Shepherd and A.P. Wyn-Jones,
"Evaluation of different filtration techniques for the
concentration of cryptosporidium oocysts from water", Water Science and
Technology, Vol.31, No5-6, pp.425-429, 1995.
9.
"Использование модельных тестов цист лямблий и ооцист криптоспоридий для
гигиенической оценки эффективности водоочистки", Методические указания
МУК4.2.1174-02, Минздрав России, 2003.
10.МУК
4.2.964-00 "Санитарно-паразитологическое исследование воды хозяйственного
и питьевого использования".
11.Методические рекомендации "Использование аналитических
трековых мембран для пробоподготовки воды и исследования на показатели
паразитарной безопасности",
Министерство здравоохранения Российской Федерации, Федеральный центр
госсанэпиднадзора, Лабораторный Совет госсанэпиднадзора,
12.Патент
России №35987
13.
Ларин В.Е. Состояние методического обеспечения санитарно-
паразитологического контроля
качества воды в России // ЭКВАТЭК-2002: Материалы конгресса // под общ. ред.
проф. Л.И.Эльпинера. √ М., 2002. √ с.719.